ENFERMAGEM, CIÊNCIAS E SAÚDE
Gerson de Souza Santos - Bacharel em Enfermagem, Especialista em Saúde da Família, Mestrado em Enfermagem, Doutorado em Ciências da Saúde - Universidade Federal de São Paulo. Atualmente professor do Curso de Medicina do Centro Universitário Ages - Irecê-Ba.
sexta-feira, 30 de julho de 2010
domingo, 25 de julho de 2010
PERDA AUDITIVA
CLASSIFICAÇÃO
Deficiência auditiva sensorioneural
Neste tipo de deficiência auditiva, o aparelho de transmissão
do som encontra-se normal, mas há uma alteração na qualidade do som. O termo sensorioneural é hoje empregado para substituir “surdez de percepção”. Engloba desde lesões sensoriais (orelha interna ou órgão de Corti) a neurais (lesões desde o nervo coclear até os núcleos auditivos no tronco). Nas deficiências auditivas do tipo sensorioneural há uma conservação de audição para sons graves com perda de audição mais acentuada em agudos. Não há, na realidade, uma curva típica, podendo a perda ser maior em graves (como ocorre na doença de Ménière e hidropisia endolinfática), ou mesmo uma curva com perdas acentuadas nas freqüências em torno de 1 kHz (como na neurolabirintite luética). As deficiências auditivas sensorioneurais podem também apresentar perdas de audição localizadas, como nos traumas acústicos ou nas deficiências auditivas induzidas pelo ruído. Aos testes de diapasão, o Rinne costuma ser positivo, o Weber lateraliza para o lado melhor e o Schwabach está encurtado. A discriminação auditiva costuma estar comprometida de maneira variável. Na maioria das vezes, sua alteração é proporcional à perda auditiva, pode ser um pouco menos acentuada quando o perfil audiométrico é plano e mais acentuada quando a lesão é neural.
As perdas de audição podem ser classificadas segundo a sua localização topográfica (condutivas, sensorioneurais, mistas, centrais e funcionais) ou conforme sua expressão clínica (hipoacusia, disacusia, surdez e anacusia).
Deficiência auditiva condutiva
As ondas sonoras não alcançando a orelha interna de forma adequada, quer por problemas na orelha externa (meato acústico) ou na orelha média (membrana do tímpano, cadeia ossicular, janelas redonda ou oval, ou mesmo a tuba auditiva) determinam uma redução da acuidade auditiva, constituindo-se em deficiências do tipo condutiva. Caracterizam-se basicamente pela diminuição da audição aos sons graves (aumento da rigidez do sistema) com certa conservação da audição aos sons agudos, apresentam o teste de Rinne negativo e o de Weber com lateralização para a orelha pior. O teste de Schwabach é prolongado e o Friedreich mais intenso na mastóide. A discriminação auditiva é de 100% e à imitanciometria (quando a membrana do tímpano está normal e a lesão localizase na orelha média) encontram-se curvas timpanométricas baixas e ausência do reflexo do músculo do estribo. O gráfico audiométrico costuma apresentar uma curva ascendente, com perdas maiores em graves. Nas otites médias crônicas, quando há
maiores comprometimentos da orelha média, o perfil da curva audiométrica pode ser plano, e quando a cadeia ossicular está íntegra ou apresenta continuidade há uma conservação da audição nas freqüências em torno de 1 kHz (freqüência de ressonância da orelha média). Quando há líquido na orelha média (otite secretória), este determina um aumento da massa além da rigidez do sistema, e os sons agudos podem se apresentar com um comprometimento maior.
As ondas sonoras não alcançando a orelha interna de forma adequada, quer por problemas na orelha externa (meato acústico) ou na orelha média (membrana do tímpano, cadeia ossicular, janelas redonda ou oval, ou mesmo a tuba auditiva) determinam uma redução da acuidade auditiva, constituindo-se em deficiências do tipo condutiva. Caracterizam-se basicamente pela diminuição da audição aos sons graves (aumento da rigidez do sistema) com certa conservação da audição aos sons agudos, apresentam o teste de Rinne negativo e o de Weber com lateralização para a orelha pior. O teste de Schwabach é prolongado e o Friedreich mais intenso na mastóide. A discriminação auditiva é de 100% e à imitanciometria (quando a membrana do tímpano está normal e a lesão localizase na orelha média) encontram-se curvas timpanométricas baixas e ausência do reflexo do músculo do estribo. O gráfico audiométrico costuma apresentar uma curva ascendente, com perdas maiores em graves. Nas otites médias crônicas, quando há
maiores comprometimentos da orelha média, o perfil da curva audiométrica pode ser plano, e quando a cadeia ossicular está íntegra ou apresenta continuidade há uma conservação da audição nas freqüências em torno de 1 kHz (freqüência de ressonância da orelha média). Quando há líquido na orelha média (otite secretória), este determina um aumento da massa além da rigidez do sistema, e os sons agudos podem se apresentar com um comprometimento maior.
Deficiência auditiva sensorioneural
Neste tipo de deficiência auditiva, o aparelho de transmissão
do som encontra-se normal, mas há uma alteração na qualidade do som. O termo sensorioneural é hoje empregado para substituir “surdez de percepção”. Engloba desde lesões sensoriais (orelha interna ou órgão de Corti) a neurais (lesões desde o nervo coclear até os núcleos auditivos no tronco). Nas deficiências auditivas do tipo sensorioneural há uma conservação de audição para sons graves com perda de audição mais acentuada em agudos. Não há, na realidade, uma curva típica, podendo a perda ser maior em graves (como ocorre na doença de Ménière e hidropisia endolinfática), ou mesmo uma curva com perdas acentuadas nas freqüências em torno de 1 kHz (como na neurolabirintite luética). As deficiências auditivas sensorioneurais podem também apresentar perdas de audição localizadas, como nos traumas acústicos ou nas deficiências auditivas induzidas pelo ruído. Aos testes de diapasão, o Rinne costuma ser positivo, o Weber lateraliza para o lado melhor e o Schwabach está encurtado. A discriminação auditiva costuma estar comprometida de maneira variável. Na maioria das vezes, sua alteração é proporcional à perda auditiva, pode ser um pouco menos acentuada quando o perfil audiométrico é plano e mais acentuada quando a lesão é neural.
Deficiência auditiva central
É relativamente rara, mal conceituada e definida. Certos pacientes, embora supostamente apresentando audição normal, não conseguem entender o que lhes é dito. Quanto mais complexa a mensagem sonora, maior dificuldade haverá. Muitos testes têm sido desenvolvidos para o diagnóstico adequado destas lesões, mas poucos parecem ter sido efetivos e empregados na prática clínica. Um destes testes, o SCAN (Screening Test for Auditory Disorders), tem o objetivo de determinar possíveis comprometimentos do sistema nervoso central na criança. Para adultos, existem os testes desenvolvidos por Katz, Keith e Jerger, porém ainda não aplicados entre nós. Há quase sempre outros distúrbios neurológicos mais sérios que terminam por predominar no quadro clínico geral.
Deficiência auditiva mista
Esta perda auditiva apresenta-se com características diversas das anteriores, pois, dependendo do predomínio do fator de condução ou da gravidade da lesão sensorial, apresentará características diferentes. Em tais casos poderemos dizer que a audição pela via aérea é pior que a óssea, a discriminação auditiva pouco comprometida, ausência de reflexo do músculo do estribo (quando a lesão localiza-se na orelha média), e os testes de diapasão são difíceis de ser interpretados, especialmente nos casos unilaterais. Podem representar um estágio evolutivo avançado de certas lesões condutivas (como na otospongiose), quando estas comprometem as espiras basais da cóclea.
Deficiência auditiva funcional
Neste tipo de disfunção auditiva (também denominada de
pseudo-hipoacusia, quando simulada), o paciente não apresenta lesões orgânicas no aparelho auditivo, quer periférico ou central. A dificuldade de entender a audição pode ser de fundo emocional ou psíquico, podendo sobrepor-se a alguma lesão auditiva prévia, apresentando pioras bruscas do quadro clínico. Representam um grande desafio à audiologia clínica e torna-se difícil determinar, em certas situações, se é uma simulação ou é orgânica. Alguns testes, como o de Stenger e métodos eletrofisiológicos, têm possibilitado algum progresso neste diagnóstico.
pseudo-hipoacusia, quando simulada), o paciente não apresenta lesões orgânicas no aparelho auditivo, quer periférico ou central. A dificuldade de entender a audição pode ser de fundo emocional ou psíquico, podendo sobrepor-se a alguma lesão auditiva prévia, apresentando pioras bruscas do quadro clínico. Representam um grande desafio à audiologia clínica e torna-se difícil determinar, em certas situações, se é uma simulação ou é orgânica. Alguns testes, como o de Stenger e métodos eletrofisiológicos, têm possibilitado algum progresso neste diagnóstico.
Marcadores:
Clínica Médica
quinta-feira, 15 de julho de 2010
CIRURGIA DE REVASCULARIZAÇÃO DO MIOCÁRDIO NAS CARDIOPATIAS ISQUÊMICAS, E SUAS COMPLICAÇÕES PÓS-OPERATÓRIAS
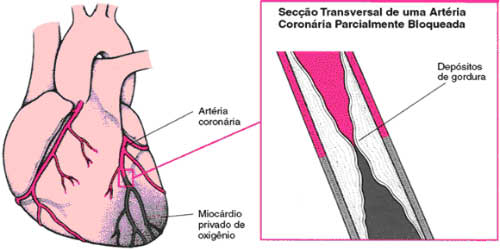
INTRODUÇÃO A doença arterial coronariana (DAC) decorre do acúmulo de gordura nas células que revestem a artéria coronária, causando obstrução, isquemia miocárdica e lesão cardíaca. As doenças coronárias que mais despertam interesse são as síndromes isquêmicas agudas e o infarto agudo domiocárdio, não só pelos altos índices de morbi-mortalidade, mas também pelo fato da isquemia miocárdica poder ocorrer na ausência de sintomas. De acordo com a gravidade da lesão arterial e das disfunções ventriculares, os pacientes têm indicação cirúrgica de revascularização do miocárdio (RM). Devido à técnica cirúrgica e via de acesso, podem surgir complicações pulmonares que constituem a maior causa de morbidade no pós-operatório, contribuindo para o surgimento de disfunções respiratórias restritivas e alvéolos capilares difusionais com conseqüente repercussão na função pulmonar. Devido o surgimento das complicações supracitadas, após o procedimento cirúrgico esses pacientes permanecem por um certo período de tempo na Unidade de Terapia Intensiva, onde se inicia o protocolo de exercícios, respeitando os limites de cada paciente. Nesta fase, o Programa de Reabilitação Cardíaca fase I (hospitalar), é direcionado pelo fisioterapeuta, visando à prevenção de complicações pulmonares da pós cirurgia. OBJETIVOS Esta pesquisa tem por objetivos, investigar, a partir da pesquisa bibliográfica, e informar aos profissionais da área de saúde, principalmente os fisioterapeutas, sobre a doença arterial coronariana, síndromes isquêmicas, tratamentos e complicações pós-operatórias da revascularização do miocárdio. METODOLOGIA Foi realizada uma pesquisa bibliográfica, do tipo exploratória. Tem como método de abordagem o dedutivo e como técnica de pesquisa a documentação indireta. DOENÇA ARTERIAL CORONARIANA A doença arterial coronariana é um distúrbio no qual depósitos de gordura acumulam-se nas células que revestem a parede da artéria coronária e obstruem o fluxo sangüíneo. As placas de ateroma formam-se gradualmente e desenvolve-se nos grandes ramos das duas artérias coronárias principais causando a aterosclerose. À medida que os ateromas crescem, alguns se rompem e fragmentos livres caem na corrente sangüínea ou pode ocorrer a formação de pequenos coágulos sangüíneos sobre sua superfície, causando assim obstrução ou o agravamento da obstrução coronariana com conseqüente isquemia do miocárdio e lesão cardíaca. A causa mais comum de isquemia do miocárdio é a doença arterial coronariana, cujas principais complicações são a angina e o infarto do miocárdio (1). A cardiopatia isquêmica é uma afecção cardíaca caracterizada principalmente pela isquemia miocárdica que em 90% dos casos é decorrente de aterosclerose coronária, justificando-se as condições em que é denominada de cardiopatia aterosclerótica ou doença coronária. Essa doença constitui um importante determinante da mortalidade e morbidade no mundo moderno, principalmente nos países industrializados, tendo como substrato etiopatogênico, a arteriosclerose (2,3,4). Fatores relacionados com a doença arterial coronariana Existem vários fatores relacionados com a gravidade da DAC (doença arterial coronariana), dentre eles pode-se citar: hipertensão arterial sistêmica, tabagismo, idade, sexo, raça (principalmente a branca), diabetes mellitus, dislipidemias, hipercolesterolemia, obesidade, sedentarismo, número de artérias comprometidas, comprometimento funcional do ventrículo esquerdo, sedentarismo e estresse (3,2). Embora haja forte predisposição genética para o desenvolvimento da doença cardiovascular, os fatores ambientais exercem papel importante sobre os fatores genéticos, de forma que o processo aterosclerótico inicia-se na infância e adolescência sendo acelerado pelos fatores de risco, e a prevenção da DAC é mais eficaz quando iniciada precocemente (6). Síndromes isquêmicas As doenças coronárias que mais despertam interesse são as síndromes isquêmicas agudas e o infarto agudo domiocárdio, não só pelos altos índices de morbi-mortalidade, mas também pelo fato da isquemia miocárdica (FIGURA I) poder ocorrer na ausência de sintomas o que é chamado isquemia silenciosa (7).
A expressão clínica clássica da insuficiência coronária decorrente da DAC é a angina pectoris, que se manifesta quando ocorre isquemia miocárdica, devido a uma obstrução arterial parcial, causando uma desproporção entre o fluxo coronário e a oferta de oxigênio, de um lado, e demandas metabólicas do miocárdio e consumo de oxigênio, de outro (9). A angina pectoris pode ser classificada de acordo com suas manifestações clínicas como angina estável, angina instável e angina de Prinzmetal. A angina estável é caracterizada por dor torácica, desencadeada por esforço físico, refeições volumosas e estresse emocional, com duração de 30 segundos a 15 minutos e é aliviada com o repouso ou com uso de medicamento, não apresentando esses sintomas em pelo menos dois meses (10). A angina instável tem várias formas de apresentação que variam desde a angina do peito de início recente até dor intensa e prolongada ao repouso, que às vezes chega a ser confundida com IAM (infarto agudo do miocárdio) (11). A angina de Prinzmetal é fisiopatologicamente caracterizada por redução da oferta, e não por aumento do consumo de O2 (oxigênio), cuja causa seria um aumento do tônus da artéria coronária com estenose crítica. Essa redução da oferta de O2 (oxigênio) é secundária ao espasmo de duas ou mais artérias obstruídas, o que pode gerar alto potencial de gravidade, dependendo da duração do espasmo e do número de artérias envolvidas (12). Na angina pectoris há um desconforto torácico, ou em áreas adjacentes semelhante a uma pressão ou sensação de dormência no peito, causada pela isquemia miocárdica desencadeada pelo esforço associada a distúrbios funcionais, mas sem necrose miocárdica. Essa dor geralmente é retroesternal, mas pode irradiar para região ulnar do braço esquerdo, podendo envolver também o braço direito e a superfície externa de ambos os braços. Além disso, apresenta fadiga, dispnéia e tontura. Se a dispnéia ocorre devido ao esforço anormal é indicador precoce de DAC, mesmo quando a angina está ausente. Mas, quando a dispnéia ocorre em repouso ou devido ao esforço pode ser a manifestação de uma isquemia muito grave (13). Quando ocorre uma estenose de alto grau causando uma oclusão completa das artérias coronárias impedindo que o fluxo sangüíneo chegue em determinada área do miocárdio e o mesmo não é suprido pela rica rede de colaterais, pode haver uma ruptura da placa de ateroma e esse trombo que interrompe a passagem do fluxo sanguíneo gera um desequilíbrio entre o fornecimento e a demanda de O2. Se esse desequilíbrio for grave e persistente, haverá necrose do miocárdio e a área necrosada perde sua capacidade contrátil, prejudicando a função sistólica do ventrículo esquerdo o que altera sua complacência e compromete assim, sua função diastólica (14). A função do ventrículo pode ser prejudicada dependendo da extensão do infarto, o que repercute no aumento da pré-carga e da pós-carga na tentativa de recuperar a função normal do miocárdio. Caso a mesma não seja restaurada está instalada a insuficiência cardíaca, decorrente da cardiopatia isquêmica (14,15). Existem, portanto, dois tipos de infarto de acordo com o ponto de vista anatomopatológico, que é o transmural que atinge mais de 1/3 da parede do ventrículo, em geral com preservação subendocárdica; e o subendocárdico que como próprio nome diz, atinge o subendocárdio (10). Sintomas do IAM Pacientes com IAM apresentam desconforto precordial descrito como aperto no peito, asfixia, dor em pontada ou dor em queimação, semelhante à angina pectoris clássica que ocorre em repouso ou em atividade diminuída além da habitual, podendo ser classificada como angina instável (14). Essa dor tem intensidade variável, na maioria dos pacientes é grave e algumas vezes intolerável, a duração é prolongada podendo durar mais de 30 minutos e freqüentemente por diversas horas. Irradia-se no trajeto ulnar do braço esquerdo, atingindo punho, mão e dedos com sensação de formigamento, em alguns pacientes há irradiação para ombros, maxilar, pescoço e região supra-escapular no lado esquerdo. Além desses sintomas o paciente pode apresentar náuseas, vômito, fraqueza, tonturas, palpitações, sudorese fria, e sensação de morte iminente (14). TRATAMENTO CIRÚRGICO Alguns pacientes, dependendo da lesão arterial e disfunções ventriculares apresentadas, têm indicação cirúrgica de revascularização do miocárdio, principalmente diante da falha do tratamento clínico em suprir a angina, objetivando-se promover o alívio dos sintomas, a melhora do estado funcional e a melhora do prognóstico do paciente (4,7,16). Revascularização do miocárdio Pacientes com cardiopatia isquêmica, principalmente os que apresentam IAM, angina instável e a isquemia silenciosa com comprometimento multiarterial, persistência da isquemia mesmo com administração de medicamentos, ou que não obtiveram êxito com outros tipos de cirurgia, têm indicação cirúrgica para RM a qual será realizada através da cirurgia de “Bypass”. Na década de 70, foi proposta a utilização da artéria radial como enxerto na RM, mas devido o alto índice de oclusão e maus resultados iniciais, a mesma deixou de ser utilizada com este fim, passando-se a utilizar os enxertos venosos (veia safena) e arteriais (artéria mamária interna) para promover a através das famosas pontes de safena, e ponte mamária, respectivamente (13,17,18). No IAM, a revascularização do miocárdio deve ser realizada quando há falha da angioplastia com persistência de isquemia refratária à instabilidade hemodinâmica; isquemia refratária à terapêutica medicamentosa; choque cardiogênico e certas alterações mecânicas (19). Técnicas cirúrgicas Quanto ao tipo de técnica cirúrgica, alguns cirurgiões têm hesitado em indicar a cirurgia de revascularização do miocárdio como primeira modalidade de terapia desses pacientes, em face da mortalidade, morbidade, custos associados à cirurgia com circulação extracorpórea e a esternotomia mediana. Esse método tradicional de cirurgia cardíaca é seguramente a técnica mais popular, realizada através de incisão esternal mediana com acesso a superfície do coração e possibilidade de acesso intracardíaco. Durante este procedimento, o mecanismo de circulação extracorpórea permite o uso de suporte circulatório e campo cirúrgico, com um coração imóvel e pouco sangue (20,4). Por outro lado, com a incidência relativamente alta de reestenose, da angioplastia e do stent, passou a existir uma preocupação dos cirurgiões em simplificar o ato operatório na cirurgia de RM, realizando-a sem circulação extracorpórea e com o coração em atividade cardíaca, permitindo assim, o avanço da cirurgia minimamente invasiva. Tais técnicas implicam em menor agressão ao paciente, menor custo, resultados mais efetivos e eliminam as maiores causas de morbi-mortalidade que são a circulação extracorpórea e a manipulação da aorta (21,20,4). Segundo (4) a incisão cirúrgica é feita em uma região especifica que pode ser: esternotomia mediana, toracotomia ântero-lateral, toracotomia antero-posterior; minitoracotomia, abdominal e tóraco-abdominal. A cirurgia de revascularização do miocárdio visa promover o aumento da circulação miocárdica em casos de grande oclusão coronariana, aliviando a isquemia e os sintomas não-tratáveis da angina (21). Sendo assim, podemos citar duas técnicas usadas para aumentar essa circulação: enxerto em retalho ou enxerto de uma veia, onde o enxerto é feito com um retalho do pericárdio ou de uma veia para aumentar o lúmen de uma veia obstruída, fazendo-se uma incisão linear que se estende acima e abaixo do local obstruído na artéria coronária (22). O enxerto em veia é a técnica que utiliza segmentos de uma veia calibrosa, geralmente a safena, para transpor segmentos comprometidos da artéria coronária. Para se restabelecer o fluxo entre a aorta e a artéria coronária abaixo da oclusão faz-se à anastomose ponta-a-ponta ou ponta-lateral. Recentemente a artéria mamária interna tem sido usada para transpor uma artéria coronária ao invés de se usar um enxerto de veia (22). Afirmam (21,23) que a ponte mamária vem sendo cada vez mais utilizada em substituição a tradicional ponte de safena nas cirurgias de revascularização miocárdica, uma vez que estudos mostram a oclusão progressiva desses enxertos. A maior vantagem do uso simultâneo das artérias mamárias (esquerda e direita) é a durabilidade em relação a ponte de safena. Apenas 75% dos enxertos de safena continuam permeáveis cinco anos após a cirurgia contra 96% das pontes de artéria mamária. Para esses autores, após 10 anos de cirurgia, a permeabilidade cai para 40%, na safena e apenas para 92%, na mamária. Esse procedimento é indicado inicialmente, para pacientes jovens, tendo seu uso ampliado para outras faixas etárias. Devido ao não manuseio da aorta, esse método também diminui os riscos de acidente vascular cerebral, especialmente quando o procedimento é utilizado sem uso da circulação extracorpórea. COMPLICAÇÕES NO PÓS-OPERATÓRIO DE CIRURGIA CARDÍACA As complicações pulmonares constituem a maior causa de morbidade no pós-operatório de cirurgia cardíaca, devido à técnica cirúrgica, via de acesso e uso da circulação extracorpórea, contribuindo para o surgimento de disfunções respiratórias restritivas e alvéolos capilares difusionais com conseqüente repercussão na função pulmonar (24). Geralmente, há alteração do padrão respiratório, que se torna predominantemente costal; diminuição dos volumes e capacidades pulmonares de 40 a 50% em relação aos seus valores pré-operatórios imediatamente após a cirurgia e em associação com a anestesia geral há redução de aproximadamente 36% na CRF (capacidade residual funcional), o que está relacionado ao relaxamento do diafragma, que promove seu deslocamento cranial prejudicando o volume torácico; relaxamento da parede torácica, que reduz o diâmetro transverso da caixa torácica interferindo no volume torácico e diminuição da complacência pulmonar total (25). Essa alteração da complacência pulmonar e da mobilidade diafragmática, o aumento da resistência das vias aéreas e a abolição dos suspiros são fatores observados depois da cirurgia cardíaca e estão implicados na diminuição da CRF com conseqüente diminuição da ventilação e da expansibilidade das bases pulmonares, conduzindo ao fechamento das pequenas vias aéreas e a ocorrência de atelectasias das zonas dependentes do pulmão. A manutenção da perfusão sanguínea nessas áreas mal ventiladas é responsável pela queda na pressão parcial de oxigênio arterial, sendo esse mecanismo de hipoxemia denominado “shunt” ou efeito “shunt” (25). Os fatores de risco para complicações pulmonares são: a dor no pós-operatório que limita os movimentos, tornando a tosse ineficaz, dificultando a respiração profunda e as mudanças de posicionamento; o edema pulmonar que tem como principal conseqüência a hipoxemia; atelectasia que pode levar a insuficiência respiratória; paralisia ou paresia do nervo frênico; e, pneumonia, principalmente a nosocomial. Além dessas complicações pode ocorrer a distensão abdominal que se torna um fator importante quando associada a hipoxemia e dispnéia, podendo causar alteração dos volumes pulmonares; a confusão mental que está relacionada com a hipoperfusão cerebral e também pode contribuir para o surgimento de complicações pulmonares (24). Pode ocorrer também parada cardio-respiratória, tamponamento cardíaco, arritmias cardíacas, insuficiência cardíaca congestiva, empiema, hemotórax, hipercapnia, hipóxia, efusão pleural, pneumotórax, angústia respiratória, enfisema subcutâneo e choque cardiogênico, infecção na incisão na perna, infarto do miocárdio, insuficiência respiratória, infecções da incisão do esterno, reoperação por sangramento mediastinal, acidente vascular encefálico, complicações gastrintestinais, insuficiência renal (21,22). Devido o surgimento das complicações supracitadas, após o procedimento cirúrgico esses pacientes permanecem por um certo período de tempo na Unidade de Terapia Intensiva, onde se inicia o protocolo de exercícios, respeitando os limites de cada paciente. Nesta fase, o Programa de Reabilitação Cardíaca fase I (hospitalar), é direcionado pelo fisioterapeuta, visando à prevenção de complicações pulmonares da cirurgia, tendo como objetivos gerais: evitar os fenômenos tromboembólicos, promover a higiene pulmonar, proporcionar a educação respiratória, atenuar a dor, melhorar a função pulmonar, restaurar a amplitude articular e força muscular e diminuir a ansiedade (4). Análise e discussão Segundo (2,3,4) a cardiopatia isquêmica é uma afecção que constitui um importante determinante da morbi-mortalidade no mundo, principalmente nos países industrializados, tendo como substrato etiopatogênico, a arteriosclerose. Pacientes que apresentam IAM, angina instável e a isquemia silenciosa com comprometimento multiarterial, persistência da isquemia mesmo com administração de medicamentos, ou que não obtiveram êxito com outros tipos de cirurgia, têm indicação cirúrgica para RM. A cirurgia de “Bypass” utiliza os enxertos de veia safena e da artéria mamária interna 13,17,18. Esse método cirúrgico é o mais popular, realizado através de incisão esternal mediana com acesso a superfície do coração e possibilidade de acesso intracardíaco. Durante o procedimento, pode ser utilizada a circulação extracorpórea que permite o uso de suporte circulatório e campo cirúrgico, com um coração imóvel e pouco sangue (4,20). Sendo assim, alguns autores (24) afirmam que podem surgir complicações pulmonares as quais contribuem para o surgimento de disfunções respiratórias restritivas e alvéolo-capilares difusionais em decorrência de certos fatores como: dor no pós-operatório, edema pulmonar, atelectasia, paralisia do nervo frênico e pneumonia. Segundo (25) as principais alterações são as seguintes: mudanças no padrão respiratório, redução dos volumes e capacidades pulmonares, diminuição da complacência pulmonar e alteração da mobilidade diafragmática, o que pode provocar atelectasia e shunts pulmonares. Podem ocorrer também complicações extra-pulmonares como: parada cardio-respiratória, insuficiência cardíaca congestiva e arritmias cardíacas (21,22). CONSIDERAÇÕES FINAIS Os autores pesquisados relatam a importância da cirurgia de revascularização do miocárdio em pacientes com cardiopatias isquêmicas severas e que não responderam à terapêutica medicamentosa. Entretanto pode-se perceber que apesar da necessidade indiscutível desta cirurgia, não podemos deixar de enfatizar a necessidade de não apenas tratar, mas também prevenir as complicações pulmonares que surgem no pós-operatório. Sendo assim, é importante o conhecimento do fisioterapeuta, principalmente o que atua na área de cardio-respiratória, sobre as cardiopatias isquêmicas e o seu tratamento cirúrgico, já que juntos podem levar ao surgimento de complicações sistêmicas secundárias que causam alterações da capacidade funcional e, conseqüentemente, na qualidade de vida desses pacientes, o que interfere diretamente na realização de suas atividades funcionais, levando o mesmo a ter a necessidade de participar de um programa de reabilitação cardíaca, com a finalidade de obter uma melhora do condicionamento físico e cardio-pulmonar. fonte: http://www.wgate.com.br/conteudo/medicinaesaude/fisioterapia/cardio/revascularizacao_fabiola/revascularizacao_fabiola.htm | |||
Marcadores:
Clínica Médica
quarta-feira, 14 de julho de 2010
DOENÇAS HEPÁTICAS
Epidemiologia
As doenças hepáticas são causas muito comuns de morbilidade e de mortalidade. O consumo crónico de álcool é, actualmente, a causa mais frequente das doenças hepáticas e contribui para a maioria dos cerca de 100 mil casos estimados de mortes anuais, nos Estados Unidos. O vírus da hepatite B é uma das infecções virais crónicas mais comuns no Mundo, com cerca de 170 milhões de pessoas infectadas. Nos países desenvolvidos, é relativamente pouco comum, com uma prevalência de 1 para 550 pessoas no Reino Unido e nos Estados Unidos.
Cerca de 300 milhões de pessoas em todo o Mundo têm infecção crónica de hepatite C. Ao contrário do vírus da hepatite B, a infecção da hepatite C não está essencialmente confinada aos países em desenvolvimento, com 0,3 a 0,7 % da população do Reino Unido infectada.
O carcinoma hepato-celular primário é um dos tumores mais comuns no Mundo. Tem especial prevalência nas regiões da Ásia e da África Sub-Sariana, devido à frequência das infecções crónicas provocadas pelos vírus da hepatite B e C.
Cerca de 300 milhões de pessoas em todo o Mundo têm infecção crónica de hepatite C. Ao contrário do vírus da hepatite B, a infecção da hepatite C não está essencialmente confinada aos países em desenvolvimento, com 0,3 a 0,7 % da população do Reino Unido infectada.
O carcinoma hepato-celular primário é um dos tumores mais comuns no Mundo. Tem especial prevalência nas regiões da Ásia e da África Sub-Sariana, devido à frequência das infecções crónicas provocadas pelos vírus da hepatite B e C.
Causas e Factores de Risco
Classificação comum
• Hepatocelular: Predominância de características de lesões hepáticas, com inflamação e necrose (por exemplo nas hepatites virais, na doença hepática alcoólica, na cirrose)
• Colestática (obstructiva): Predominância de características de inibição do fluxo da bílis (por exemplo, pedras na visícula biliar, obstrução maligna, cirrose biliar primária, muitas doenças hepáticas induzidas por fármacos ou químicos)
• Hepatocelular: Predominância de características de lesões hepáticas, com inflamação e necrose (por exemplo nas hepatites virais, na doença hepática alcoólica, na cirrose)
• Colestática (obstructiva): Predominância de características de inibição do fluxo da bílis (por exemplo, pedras na visícula biliar, obstrução maligna, cirrose biliar primária, muitas doenças hepáticas induzidas por fármacos ou químicos)
As causas mais frequentes das doenças hepáticas nos cuidados de saúde primários são:
Hepatite viral
A hepatite viral é classificada como hepatite aguda (inflamação do fígado auto-limitada < 6 meses) e hepatite crónica (inflamação hepática > 6 meses).
Hepatite viral
A hepatite viral é classificada como hepatite aguda (inflamação do fígado auto-limitada < 6 meses) e hepatite crónica (inflamação hepática > 6 meses).
Transmissão
Hepatite A
Primariamente feco-oral
Primariamente feco-oral
Hepatite B
• Exposição percutânea (agulhas), incluindo os acidentes nos cuidados de saúde
• Exposição a produtos sanguíneos
• Contacto sexual
• Exposição perinatal
Hepatite C
• Exposição percutânea (agulhas), incluindo os acidentes nos cuidados de saúde (taxa de infecção 4-10 %)
• Exposição a produtos sanguíneos (contribuem em 85% para as hepatites associadas a transfusões)
• Transplante de órgãos
• Transmissão vertical de mãe para filho
• Não existe factor de risco parental em 40% dos casos
• A transmissão via sexual é menos comum
• Exposição percutânea (agulhas), incluindo os acidentes nos cuidados de saúde
• Exposição a produtos sanguíneos
• Contacto sexual
• Exposição perinatal
Hepatite C
• Exposição percutânea (agulhas), incluindo os acidentes nos cuidados de saúde (taxa de infecção 4-10 %)
• Exposição a produtos sanguíneos (contribuem em 85% para as hepatites associadas a transfusões)
• Transplante de órgãos
• Transmissão vertical de mãe para filho
• Não existe factor de risco parental em 40% dos casos
• A transmissão via sexual é menos comum
| Virus | Factores de risco | Características |
|---|---|---|
| Hepatite A vírus (HAV) Vírus de RNA | Viagens a países em desenvolvimento Contacto doméstico próximo Consumo de moluscos ao natural | Causa mais hepatites do que todos os outros vírus hepatotróficos em conjunto Leva frequentemente a formas sub-clínicas da doença A Hepatite A é normalmente auto-limitada |
| Hepatite B vírus (HBV) DNA Vírus | Toxicodependência Homossexuais masculinos Diálise crónica Viagem de zonas endémicas Profissionais da saúde | Principal causa de morte relacionada com cirrose e carcinoma hepato-celular, em todo o Mundo 10% desenvolvem um estado crónico de portadores e constituem uma fonte de infecção |
| Hepatite C Vírus (HCV)Vírus RNA | Toxicodependência Transfusões de sangue Tatuagens Profissionais da saúde Pode ser transmitida por via sexual (baixa incidência) | Elevada taxa de mutação, logo não é facilmente neutralizado pela resposta imunitária do organismo A infecção aguda é normalmente assintomática 75% desenvolvem doença crónica, 20% desenvolvem, eventualmente, cirrose Vírus da hepatite D: co-infecta e necessita do HBV para se replicar Vírus da hepatite E: Transmitido por via entérica, ocorre principalmente na Índia, Ásia, África e na América Central. |
Doença hepática alcoólica
A ingestão crónica e em excesso de álcool é uma das principais causas da doença hepática no Mundo ocidental. Normalmente, os danos provocados pelo álcool no fígado compreendem três formas principais:
• Fígado gordo: presente em 90% de consumidores frequentes e dos alcoólicos.
• Hepatite alcoólica: presente em 15% dos alcoólicos
• Cirrose: presente em mais de 50% das hepatites alcoólicas comprovadas.
A ingestão crónica e em excesso de álcool é uma das principais causas da doença hepática no Mundo ocidental. Normalmente, os danos provocados pelo álcool no fígado compreendem três formas principais:
• Fígado gordo: presente em 90% de consumidores frequentes e dos alcoólicos.
• Hepatite alcoólica: presente em 15% dos alcoólicos
• Cirrose: presente em mais de 50% das hepatites alcoólicas comprovadas.
Factores de risco para as doenças hepáticas alcoólicas
Quantidade
Homens: 40-80 g/dia (mulheres: 20-40 g/dia) leva a fígado gordo; 80-120 g/dia (mulheres: 60-100 g/dia), durante 10-20 anos, causa hepatite ou cirrose; apenas 15% dos alcoólicos desenvolvem a doença hepática alcoólica.
Homens: 40-80 g/dia (mulheres: 20-40 g/dia) leva a fígado gordo; 80-120 g/dia (mulheres: 60-100 g/dia), durante 10-20 anos, causa hepatite ou cirrose; apenas 15% dos alcoólicos desenvolvem a doença hepática alcoólica.
Sexo:
As mulheres são mais susceptíveis à doença hepática alcoólica
As mulheres são mais susceptíveis à doença hepática alcoólica
Hepatite C:
A existência de infecção está associada ao progresso mais rápido da doença
A existência de infecção está associada ao progresso mais rápido da doença
Factores Genéticos:
Álcool desidrogenase. Acetaldeído desidrogenase. Citocromo P4502E1.
Álcool desidrogenase. Acetaldeído desidrogenase. Citocromo P4502E1.
Má Nutrição:
A hepatotoxicidade alcoólica não exige má nutrição
A hepatotoxicidade alcoólica não exige má nutrição
Cirrose
A cirrose está associada a um conjunto de manifestações clínicas. As características patológicas cardinais reflectem danos crónicos e irreversíveis do parênquima hepático e inclui fibrose extensa associada à formação de nódulos regenerativos.
• Características clínicas: icterícia, edema, coagulopatia, hipertensão portal, ascite, encefalopatia hepática
• Classificação/etiologia: alcoólica, criptogénica e pós-hepatite, biliar, cardíaca, metabólica, herdada e relacionada com drogas.
A cirrose está associada a um conjunto de manifestações clínicas. As características patológicas cardinais reflectem danos crónicos e irreversíveis do parênquima hepático e inclui fibrose extensa associada à formação de nódulos regenerativos.
• Características clínicas: icterícia, edema, coagulopatia, hipertensão portal, ascite, encefalopatia hepática
• Classificação/etiologia: alcoólica, criptogénica e pós-hepatite, biliar, cardíaca, metabólica, herdada e relacionada com drogas.
Carcinoma hepato-celular O carcinoma hepato-celular primário é um dos tumores mais comuns a nível mundial. Tem uma prevalência especial nas regiões da Ásia e da África Sub-sahariana. É mais comum nos homens do que nas mulheres e normalmente surge num fígado já com cirrose. A doença hepática crónica de qualquer tipo predispõe para o desenvolvimento do carcinoma hepato-celular, incluindo a infecção crónica com HBV e HCV, doença hepática alcoólica.
Pedras na vesícula biliar
As pedras na vesícula biliar são relativamente prevalentes na maioria dos países ocidentais, nomeadamente colesterol e pedras mistas. O sintoma mais específico e característico é a cólica biliar do epigastro ou do quadrante superior direito.
Os factores de risco associados correspondem à regra dos seis: Mulher, Pele Clara, Gordura, Quarenta Anos, Fecunda, Família com antecedentes da doença.
História natural de uma pedra da vesícula silenciosa: baixo risco acumulado de desenvolvimento de complicações: 10 % até 5 anos, 15% até 10 anos, 18% até 15 anos
As complicações são comuns em pacientes que tiveram cólica biliar.
Colecistite aguda
Inflamação aguda da parede da vesícula biliar, que surge no seguimento de obstrução dos ductos císticos por uma pedra. A inflamação bacteriana também pode ocorrer em 50 a 85% dos pacientes. A Colecistite aguda começa frequentemente com uma crise de cólicas biliares que piora progressivamente. Sintomas como o início súbito de sensibilidade do quadrante superior direito, febre e leucocitose, são muito sugestivos.
Pedras na vesícula biliar
As pedras na vesícula biliar são relativamente prevalentes na maioria dos países ocidentais, nomeadamente colesterol e pedras mistas. O sintoma mais específico e característico é a cólica biliar do epigastro ou do quadrante superior direito.
Os factores de risco associados correspondem à regra dos seis: Mulher, Pele Clara, Gordura, Quarenta Anos, Fecunda, Família com antecedentes da doença.
História natural de uma pedra da vesícula silenciosa: baixo risco acumulado de desenvolvimento de complicações: 10 % até 5 anos, 15% até 10 anos, 18% até 15 anos
As complicações são comuns em pacientes que tiveram cólica biliar.
Colecistite aguda
Inflamação aguda da parede da vesícula biliar, que surge no seguimento de obstrução dos ductos císticos por uma pedra. A inflamação bacteriana também pode ocorrer em 50 a 85% dos pacientes. A Colecistite aguda começa frequentemente com uma crise de cólicas biliares que piora progressivamente. Sintomas como o início súbito de sensibilidade do quadrante superior direito, febre e leucocitose, são muito sugestivos.
Diagnóstico
Sintomas constitucionais
•Fadiga: Típica após actividade e rara de manhã depois do descanso
•Náuseas: pode ser provocada pelo cheiro da comida ou pela ingestão de alimentos gordos
•Perda de apetite: normal em doenças hepáticas agudas
Sintomas específicos do fígado
•Icterícia: sintoma cutâneo de doença hepática e talvés o marcador de gravidade mais fiável
•Urina escura, normalmente detectada antes de icterus escleral.
•Fezes claras: com colestase grave
•Comichão: ocorre precocemente no caso de icterícia obstrutiva e mais tardiamente na doença hepato-celular (doenças hepáticas agudas); na doença hepática crónica, tipicamente na forma colestática (por exemplo na cirrose biliar primária, colangite esclerosa), ocorre com frequência antes do aparecimento de icterícia
•Dor abdominal: desconforto ou dor no quadrante superior direito, sensibilidade sobre a zona do fígado - a dor intensa é típica dos casos de doença da vesícula biliar
•Fadiga: Típica após actividade e rara de manhã depois do descanso
•Náuseas: pode ser provocada pelo cheiro da comida ou pela ingestão de alimentos gordos
•Perda de apetite: normal em doenças hepáticas agudas
Sintomas específicos do fígado
•Icterícia: sintoma cutâneo de doença hepática e talvés o marcador de gravidade mais fiável
•Urina escura, normalmente detectada antes de icterus escleral.
•Fezes claras: com colestase grave
•Comichão: ocorre precocemente no caso de icterícia obstrutiva e mais tardiamente na doença hepato-celular (doenças hepáticas agudas); na doença hepática crónica, tipicamente na forma colestática (por exemplo na cirrose biliar primária, colangite esclerosa), ocorre com frequência antes do aparecimento de icterícia
•Dor abdominal: desconforto ou dor no quadrante superior direito, sensibilidade sobre a zona do fígado - a dor intensa é típica dos casos de doença da vesícula biliar
Avaliação dos factores de risco
Perguntas: suspeita de problemas alcoólicos
Já alguma vez sentiu que deve cortar nas bebidas?
Alguma vez o aborreceram por causa da bebida?
Alguma vez se sentiu culpado ou mal por causa de beber?
Alguma vez tomou uma bebida logo de manhã para acalmar os nervos ou para se livrar de uma ressaca?
Já alguma vez sentiu que deve cortar nas bebidas?
Alguma vez o aborreceram por causa da bebida?
Alguma vez se sentiu culpado ou mal por causa de beber?
Alguma vez tomou uma bebida logo de manhã para acalmar os nervos ou para se livrar de uma ressaca?
Exame físico Em muitos pacientes o exame físico é normal a menos que a doença seja aguda, grave ou avançada. No entanto, pode revelar a primeira evidência de insuficiência hepática, hipertensão portal e descompensação hepática.
•Icterícia
•Aranha vascular
•Hepatomegália
•Esplenomegália
•Sinais de doença hepática avançada: perda de massa muscular, perda de peso, hapatomegalia, nódoas negras, ascite, edema com ou sem ascite, ginecomastia, efeminização
•Insuficiência hepática: alteração dos padrões de sono, mudança de personalidade, irritabilidade e preguiça mental; posteriormente: confusão, desorientação, estupor e eventualmente coma
•Icterícia
•Aranha vascular
•Hepatomegália
•Esplenomegália
•Sinais de doença hepática avançada: perda de massa muscular, perda de peso, hapatomegalia, nódoas negras, ascite, edema com ou sem ascite, ginecomastia, efeminização
•Insuficiência hepática: alteração dos padrões de sono, mudança de personalidade, irritabilidade e preguiça mental; posteriormente: confusão, desorientação, estupor e eventualmente coma
Procedimentos de diagnóstico
Análises ao fígado
O diagnóstico das doenças hepáticas é muito auxiliado pela existência de testes de diagnóstico da função e lesão hepáticas, precisos e sensíveis. Um painel hepático típico de testes para a avaliação inicial inclui:
•Transaminase Glutâmica-oxaloacética (GOT); sin.: Aspartato aminotransferase (AST)
•Transaminase Glutâmica-pirúvica (GPT); sin.: Alanina aminotransferase (ALT)
•Fosfatase alcalina (ALP)
•γ-Glutamiltransferase (GGT)
•Bilirubina sérica total e directa
•Proteína, albumina
•Tempo de Protrombina (PT)
Análises ao fígado
O diagnóstico das doenças hepáticas é muito auxiliado pela existência de testes de diagnóstico da função e lesão hepáticas, precisos e sensíveis. Um painel hepático típico de testes para a avaliação inicial inclui:
•Transaminase Glutâmica-oxaloacética (GOT); sin.: Aspartato aminotransferase (AST)
•Transaminase Glutâmica-pirúvica (GPT); sin.: Alanina aminotransferase (ALT)
•Fosfatase alcalina (ALP)
•γ-Glutamiltransferase (GGT)
•Bilirubina sérica total e directa
•Proteína, albumina
•Tempo de Protrombina (PT)
Testes iniciais para pacientes com hepatites
Hepatite aguda
•HBsAg - representa a infecção HBV, se presente
•IgM anti-HAV - diagnóstico de hepatite A aguda, se presente
•IgM anti HBc – infecção HVB considerada aguda, se presente (mesmo na ausência de HbsAg)
•anti-HCV –apoia o diagnostico de hepatite C, se detectável
Hepatite crónica
•HbsAg – representa infecção por HBV, se presente
•anti-HCV – quando detectável, suporta um diagnóstico de hepatite C (determinada por teste ao HCV RNA)
Diagnóstico por imagiologia
A ecografia é o método de diagnóstico aplicado com mais frequência para a detecção de doenças hepatobiliares nos cuidados de saúde primários. Consegue detectar a dilatação dos ductos biliares, fígado gordo, cirrose e é uma opção de primeira linha para pacientes com icterícia obstrutiva.
Tomografia computorizada (TAC) e ressonância magnética (RM):
Identificação e avaliação de massa hepática, estado de tumores hepáticos, avaliação pré-operatória.
Colangiopancreatografia Retrógrada Endoscópica (ERCP): procedimento de escolha para a visualização do tronco biliar; fornece opções terapêuticas, como por exemplo a extracção de pedras, colocação de cateteres nasobiliares e de stents biliares.
Biopsia do Fígado
A biopsia do fígado continua a ser o procedimento padrão mais indicado para a avaliação de pacientes com doença hepática, especialmente em pacientes com doença hepática crónica.
•HBsAg - representa a infecção HBV, se presente
•IgM anti-HAV - diagnóstico de hepatite A aguda, se presente
•IgM anti HBc – infecção HVB considerada aguda, se presente (mesmo na ausência de HbsAg)
•anti-HCV –apoia o diagnostico de hepatite C, se detectável
Hepatite crónica
•HbsAg – representa infecção por HBV, se presente
•anti-HCV – quando detectável, suporta um diagnóstico de hepatite C (determinada por teste ao HCV RNA)
Diagnóstico por imagiologia
A ecografia é o método de diagnóstico aplicado com mais frequência para a detecção de doenças hepatobiliares nos cuidados de saúde primários. Consegue detectar a dilatação dos ductos biliares, fígado gordo, cirrose e é uma opção de primeira linha para pacientes com icterícia obstrutiva.
Tomografia computorizada (TAC) e ressonância magnética (RM):
Identificação e avaliação de massa hepática, estado de tumores hepáticos, avaliação pré-operatória.
Colangiopancreatografia Retrógrada Endoscópica (ERCP): procedimento de escolha para a visualização do tronco biliar; fornece opções terapêuticas, como por exemplo a extracção de pedras, colocação de cateteres nasobiliares e de stents biliares.
Biopsia do Fígado
A biopsia do fígado continua a ser o procedimento padrão mais indicado para a avaliação de pacientes com doença hepática, especialmente em pacientes com doença hepática crónica.
Prevenção
A prevenção de doenças hepáticas consiste principalmente em evitar os factores de risco das doenças hepáticas ou na profilaxia por imunização:
Modificação de factores de risco
• Abstinência ou redução do consumo de álcool (doença hepática alcoólica, deterioração de outras doenças hepáticas)
• Cuidados em relação a contactos íntimos e utilização de preservativos quando sexualmente activo (HBV, HCV, HDV) – o vírus da hepatite B também está presente na saliva e, ao contrário do HIV, também se pode transmitir através deste fluído
• Cuidados de higiene do viajante (HAV)
• Evitar a exposição acidental ao sangue e a agulhas (HBV, HCV) – a probabilidade de infecção com HBV através de agulhas é aproximadamente 500 vezes maior do que a de infecção com HIV
• Evitar a partilha de seringas em caso de abuso de drogas (HBV, HCV)
• Evitar drogas potencialmente hepato-tóxicas para a prevenção do desenvolvimento da doença hepática
Modificação de factores de risco
• Abstinência ou redução do consumo de álcool (doença hepática alcoólica, deterioração de outras doenças hepáticas)
• Cuidados em relação a contactos íntimos e utilização de preservativos quando sexualmente activo (HBV, HCV, HDV) – o vírus da hepatite B também está presente na saliva e, ao contrário do HIV, também se pode transmitir através deste fluído
• Cuidados de higiene do viajante (HAV)
• Evitar a exposição acidental ao sangue e a agulhas (HBV, HCV) – a probabilidade de infecção com HBV através de agulhas é aproximadamente 500 vezes maior do que a de infecção com HIV
• Evitar a partilha de seringas em caso de abuso de drogas (HBV, HCV)
• Evitar drogas potencialmente hepato-tóxicas para a prevenção do desenvolvimento da doença hepática
Medicamentos potencialmente hepato-tóxicos
Analgésicos
• AINE’s (evitar em pacientes com doença hepática)
• Paracetamol (> 4 grama em 24 horas nos adultos; limitar a < 2 grama na doença hepática crónica)
• Medicação para a diabetes: Acarbose, Pioglitazona, Sulfonilureias
• Medicação para baixar os lípidos: Estatinas, Ácido Nicotínico
Antibióticos
• Amoxicilina / Clavulanate, Eritromicina, Isoniazida, Nitrofurantoína, Tetraciclina
• Medicação Anti-fúngica: Fluconazole, Itraconazole, Cetoconazole
• Medicação Anti-convulções: Fenitoína
• Ácido Valproico
• AINE’s (evitar em pacientes com doença hepática)
• Paracetamol (> 4 grama em 24 horas nos adultos; limitar a < 2 grama na doença hepática crónica)
• Medicação para a diabetes: Acarbose, Pioglitazona, Sulfonilureias
• Medicação para baixar os lípidos: Estatinas, Ácido Nicotínico
Antibióticos
• Amoxicilina / Clavulanate, Eritromicina, Isoniazida, Nitrofurantoína, Tetraciclina
• Medicação Anti-fúngica: Fluconazole, Itraconazole, Cetoconazole
• Medicação Anti-convulções: Fenitoína
• Ácido Valproico
Medicação Psicotrópica
• Bupropiona, Antidepressivos
• Tricíclicos, Chlorpromazina
• Medicação Hormonal: Tamoxifeno e Testosterona
• Medicações mistas: Halotano e Metotrexato
• Etretinato
• Bupropiona, Antidepressivos
• Tricíclicos, Chlorpromazina
• Medicação Hormonal: Tamoxifeno e Testosterona
• Medicações mistas: Halotano e Metotrexato
• Etretinato
É ainda importante evitar-se suplementos potencialmente hepato-tóxicos para a prevenção da evolução da doença hepática, como por exemplo alguns cogumelos (espécie amanita), equinácia, gentiana, ferro, visco (ou erva-de-passarinho norte americana), extracto do fruto de sene, raíz de valeriana, vitamina A. Instituir uma dieta de baixo teor de gorduras e evitar agentes químicos potencialmente hepato-tóxicos, como por exemplo aerossóis de limpeza, insecticidas, são outras das medidas para evitar a evolução da doença.
Vacinação
• Vacina da hepatite A - Indicada a viajantes para regiões com hepatite A endémica, utilizadores de drogas ilícitas, homossexuais masculinos, pacientes com doenças hepáticas crónicas ou com deficiências de factores de coagulação.
Anti-corpos protectores à 4ª semana em 98-100% dos pacientes
A protecção dura pelo menos 10 anos depois dos reforços
• Vacina da hepatite B - Indicada para todos os profissionais da saúde, pacientes em hemodiálise, pacientes que necessitem de transfusões de sangue frequentes, pessoal e residentes de casas de acolhimento para deficientes, homossexuais masculinos e os seus parceiros sexuais, toxicodependentes, parceiros sexuais de portadores de HBsAg crónico, pacientes com doença hepática crónica.
A imunidade pode durar toda a vida, no entanto, os reforços são efectuados em função do padrão titulação.
Nota: Em 90% das transmissões do vírus da hepatite B de mãe infectada para o bebé, a situação pode ser prevenida através da vacinação do bebé.
• Vacina da hepatite A - Indicada a viajantes para regiões com hepatite A endémica, utilizadores de drogas ilícitas, homossexuais masculinos, pacientes com doenças hepáticas crónicas ou com deficiências de factores de coagulação.
Anti-corpos protectores à 4ª semana em 98-100% dos pacientes
A protecção dura pelo menos 10 anos depois dos reforços
• Vacina da hepatite B - Indicada para todos os profissionais da saúde, pacientes em hemodiálise, pacientes que necessitem de transfusões de sangue frequentes, pessoal e residentes de casas de acolhimento para deficientes, homossexuais masculinos e os seus parceiros sexuais, toxicodependentes, parceiros sexuais de portadores de HBsAg crónico, pacientes com doença hepática crónica.
A imunidade pode durar toda a vida, no entanto, os reforços são efectuados em função do padrão titulação.
Nota: Em 90% das transmissões do vírus da hepatite B de mãe infectada para o bebé, a situação pode ser prevenida através da vacinação do bebé.
Monitorização
Todos os pacientes com doença hepática necessitam de um seguimento cuidadoso, em especial aqueles que sofrem de doença hepática crónica. A monitorização regular é essencial para que se possa dar conta de qualquer progressão da doença.
Aspectos gerais
História Clínica
• Avaliação regular dos factores de risco ou hábitos que possam fazer com que a doença piore: por exemplo o consumo de álcool, medicação (incluindo compostos de ervanária e contraceptivos), actividade sexual
• Perguntar por sintomas recentes que revelem evolução negativa: por exemplo a fadiga, náuseas, icterícia, comichão
Exame físico
• Procure sintomas de doença hepática (avançada): por exemplo aranha em aranha (ou vascular) hepato-esplenomegália, perda de massa muscular, perda de peso, nódoas negras, ascite, edema, ginecomastia, efeminização
Análises ao fígado
•Verificar a função hepática com regularidade
O painel de testes ao fígado deverá incluir :
- GOT, GPT
- Bilirrubina total
- ALP, possivelmente GGT
• Avaliação regular dos factores de risco ou hábitos que possam fazer com que a doença piore: por exemplo o consumo de álcool, medicação (incluindo compostos de ervanária e contraceptivos), actividade sexual
• Perguntar por sintomas recentes que revelem evolução negativa: por exemplo a fadiga, náuseas, icterícia, comichão
Exame físico
• Procure sintomas de doença hepática (avançada): por exemplo aranha em aranha (ou vascular) hepato-esplenomegália, perda de massa muscular, perda de peso, nódoas negras, ascite, edema, ginecomastia, efeminização
Análises ao fígado
•Verificar a função hepática com regularidade
O painel de testes ao fígado deverá incluir :
- GOT, GPT
- Bilirrubina total
- ALP, possivelmente GGT
Pacientes com hepatite
- Ver os pacientes com hepatite viral aguda com intervalos de 1 a 2 semanas até os níveis de transaminases estarem normais (normalmente leva 4 a 12 semanas).
- Nas hepatites B e C agudas, a serologia deve ser repetida após 6 meses, mesmo se os testes da função hepática estiverem normais. No caso de infecção crónica, se não for tratada, os pacientes devem ser reavaliados regularmente com intervalos de um ano ou menos, se possível por um clínico especialista destas doenças.
- Se for um caso de doença crónica, deve testar a função hepática com regularidade e fazer uma estimativa do peso da doença e da sua actividade, respectivamente.
- Monitorizar a terapia da hepatite pela avaliação da função hepática e - no caso de hepatites virais - monitorizar a replicação do vírus.
- Identificar outras pessoas em risco de infecção com hepatite viral, para que possam ser aconselhadas e referenciadas para acompanhamento médico.
Monitorização da hepato-toxicidade de doença hepática crónica
Cada paciente com doença hepática crónica deverá ser monitorizado quando receber um fármaco potencialmente hepato-tóxico
Testes de laboratório: valor base, aproximadamente cada 1-2 semanas no primeiro mês, todos os meses nos próximos três meses, todos os trimestres até a medicação parar.
Parar a medicação se a função hepática aumentar nos testes > 2x acima do limite de referência superior ou se se desenvolverem sintomas relacionados com o fígado.
Monitorização de progressão e/ou complicações das doenças hepáticas crónica
- Cirrose: um marcador frequente da presença de cirrose num paciente que esteja a ser seguido por causa de doença hepática crónica é uma diminuição progressiva na contagem de plaquetas. Use ecografia para imagiologia no seu consultório.
- Hipertensão portal: revela-se normalmente por sintomas clínicos como a esplenomegalia, ascite, encefalopatia. As varizes esofágicas são melhor documentadas por esofagoscopia.
- Peritonite bacteriana espontânea: os pacientes com ascite e cirrose podem desenvolver uma peritonite bacteriana aguda sem uma fonte primária óbvia de infecção.
- Carcinoma hepato-celular: dor abdominal com a detecção de uma massa abdominal constiuem suspeita de carcinoma hepato-celular. Verifique a fosfatase alcalina e a α-fetoprotein, que normalmentes estão elevadas. O diagnóstico de imagiologia nos cuidados de saúde primários é feito por ecografia.
- Nas hepatites B e C agudas, a serologia deve ser repetida após 6 meses, mesmo se os testes da função hepática estiverem normais. No caso de infecção crónica, se não for tratada, os pacientes devem ser reavaliados regularmente com intervalos de um ano ou menos, se possível por um clínico especialista destas doenças.
- Se for um caso de doença crónica, deve testar a função hepática com regularidade e fazer uma estimativa do peso da doença e da sua actividade, respectivamente.
- Monitorizar a terapia da hepatite pela avaliação da função hepática e - no caso de hepatites virais - monitorizar a replicação do vírus.
- Identificar outras pessoas em risco de infecção com hepatite viral, para que possam ser aconselhadas e referenciadas para acompanhamento médico.
Monitorização da hepato-toxicidade de doença hepática crónica
Cada paciente com doença hepática crónica deverá ser monitorizado quando receber um fármaco potencialmente hepato-tóxico
Testes de laboratório: valor base, aproximadamente cada 1-2 semanas no primeiro mês, todos os meses nos próximos três meses, todos os trimestres até a medicação parar.
Parar a medicação se a função hepática aumentar nos testes > 2x acima do limite de referência superior ou se se desenvolverem sintomas relacionados com o fígado.
Monitorização de progressão e/ou complicações das doenças hepáticas crónica
- Cirrose: um marcador frequente da presença de cirrose num paciente que esteja a ser seguido por causa de doença hepática crónica é uma diminuição progressiva na contagem de plaquetas. Use ecografia para imagiologia no seu consultório.
- Hipertensão portal: revela-se normalmente por sintomas clínicos como a esplenomegalia, ascite, encefalopatia. As varizes esofágicas são melhor documentadas por esofagoscopia.
- Peritonite bacteriana espontânea: os pacientes com ascite e cirrose podem desenvolver uma peritonite bacteriana aguda sem uma fonte primária óbvia de infecção.
- Carcinoma hepato-celular: dor abdominal com a detecção de uma massa abdominal constiuem suspeita de carcinoma hepato-celular. Verifique a fosfatase alcalina e a α-fetoprotein, que normalmentes estão elevadas. O diagnóstico de imagiologia nos cuidados de saúde primários é feito por ecografia.
FONTE: http://www.roche.pt/portugal
Marcadores:
Clínica Médica
terça-feira, 13 de julho de 2010
SISTEMA ENDÓCRINO
Sistema Endócrino
O que é o sistema endócrino?
O sistema endócrino é um sistema complexo de glândulas. Glândulas são órgãos pequenos mas importantes, cuja função é produzir hormônios. Hormônios são substâncias que ajudam a controlar as atividades do seu corpo. Os hormônios controlam a reprodução, o metabolismo (“queima” dos alimentos e eliminação de resíduos), o crescimento e o desenvolvimento. Os hormônios também controlam a maneira pela qual você responde ao meio ambiente, e ajudam a regular a quantidade exata de energia e nutrientes que o seu corpo precisa para funcionar.
O sistema endócrino é um sistema complexo de glândulas. Glândulas são órgãos pequenos mas importantes, cuja função é produzir hormônios. Hormônios são substâncias que ajudam a controlar as atividades do seu corpo. Os hormônios controlam a reprodução, o metabolismo (“queima” dos alimentos e eliminação de resíduos), o crescimento e o desenvolvimento. Os hormônios também controlam a maneira pela qual você responde ao meio ambiente, e ajudam a regular a quantidade exata de energia e nutrientes que o seu corpo precisa para funcionar.
Quais são as glândulas endócrinas?
As glândulas endócrinas incluem a tireóide, as paratireóides, o pâncreas, os ovários, os testículos, as supra-renais, a hipófise e o hipotálamo, dentre outras.
As glândulas endócrinas incluem a tireóide, as paratireóides, o pâncreas, os ovários, os testículos, as supra-renais, a hipófise e o hipotálamo, dentre outras.
Tireóide
A tireóide é uma glândula pequena que fica localizada na região anterior do pescoço, em frente à passagem do ar (traquèia) e abaixo do pomo-de-Adão. Os hormônios da tireóide controlam o seu metabolismo, que é a capacidade do corpo quebrar os nutrientes provenientes dos alimentos para armazená-los na forma de gordura, e também a capacidade de “queimar” esses nutrientes para produzir energia.
A tireóide é uma glândula pequena que fica localizada na região anterior do pescoço, em frente à passagem do ar (traquèia) e abaixo do pomo-de-Adão. Os hormônios da tireóide controlam o seu metabolismo, que é a capacidade do corpo quebrar os nutrientes provenientes dos alimentos para armazená-los na forma de gordura, e também a capacidade de “queimar” esses nutrientes para produzir energia.
A tireóide produz 2 hormônios, o T3 (ou tri-iodotironina) e o T4 (ou tiroxina). As doenças da tireóide resultam do excesso ou da falta desses hormônios.
Os sintomas do hipotireoidismo (falta de hormônios tireoidianos) incluem: falta de energia, batimentos cardíacos muito lentos, pele seca, intestino preso, e sensação de frio o tempo todo. Em crianças, o hipotireoidismo comumente leva à diminuição do crescimento. Bebês nascidos com hipotireoidismo podem apresentar atraso do desenvolvimento e retardo mental se não tratados adequadamente. Em adultos, o hipotireoidismo freqüentemente provoca um ganho discreto de peso. Um aumento da tireóide, ou bócio, pode ocorrer. O hipertireoidismo (hormônio tireoidiano em excesso) pode resultar em bócio com aumento exagerado dos olhos (exoftalmia), o que é conhecido como Doença de Graves. Os sintomas do hipertireoidismo incluem: ansiedade, batimentos cardíacos muito rápidos (taquicardia), diarréia, perda de peso sem motivo, fome demasiada, suor excessivo, tremores e fraqueza muscular. Um aumento do tamanho da tireóide (bócio) e inchaço atrás dos olhos, que empurra os olhos para a frente, tornando-os maiores e mais saltados, são características comuns desse distúrbio.
Pâncreas
O pâncreas é uma glândula grande, localizada no abdome, atrás do estômago, cuja função é ajudar a manter os níveis normais de açúcar (glicose) no sangue. O pâncreas secreta a insulina, que é um hormônio que controla a passagem da glicose do sangue para o interior das células, onde será usada para a produção de energia. O pâncreas também secreta o glucagon, que aumenta o nível de glicose no sangue quando este se encontra baixo demais. O glucagon faz com que o fígado libere glicose no sangue. O diabetes mellitus é um desequilíbrio dos níveis de glicose no sangue. Ocorre quando o pâncreas não produz insulina suficiente (diabetes tipo 1) ou quando a insulina produzida pelo pâncreas não age adequadamente, devido a uma resistência do corpo à ação da insulina (diabetes tipo 2). Sem insulina suficiente para fazer a glicose passar para o interior das células, esta glicose acaba se acumulando no sangue, onde atinge níveis maiores que o normal. No diabetes tipo 1, mais comum em pessoas jovens e magras, o paciente precisa tomar injeções de insulina. No diabetes tipo 2, que acomete principalmente pessoas de meia-idade com excesso de peso, o paciente pode ser tratado com exercício, dieta e outras medicações, mas algumas vezes pode precisar tomar injeções de insulina também. (Leia mais sobre diabetes clicando aqui).
O pâncreas é uma glândula grande, localizada no abdome, atrás do estômago, cuja função é ajudar a manter os níveis normais de açúcar (glicose) no sangue. O pâncreas secreta a insulina, que é um hormônio que controla a passagem da glicose do sangue para o interior das células, onde será usada para a produção de energia. O pâncreas também secreta o glucagon, que aumenta o nível de glicose no sangue quando este se encontra baixo demais. O glucagon faz com que o fígado libere glicose no sangue. O diabetes mellitus é um desequilíbrio dos níveis de glicose no sangue. Ocorre quando o pâncreas não produz insulina suficiente (diabetes tipo 1) ou quando a insulina produzida pelo pâncreas não age adequadamente, devido a uma resistência do corpo à ação da insulina (diabetes tipo 2). Sem insulina suficiente para fazer a glicose passar para o interior das células, esta glicose acaba se acumulando no sangue, onde atinge níveis maiores que o normal. No diabetes tipo 1, mais comum em pessoas jovens e magras, o paciente precisa tomar injeções de insulina. No diabetes tipo 2, que acomete principalmente pessoas de meia-idade com excesso de peso, o paciente pode ser tratado com exercício, dieta e outras medicações, mas algumas vezes pode precisar tomar injeções de insulina também. (Leia mais sobre diabetes clicando aqui).
Uma condição chamada hiperinsulinismo é causada pelo excesso de insulina, e leva à diminuição da glicose no sangue para níveis abaixo do normal (hipoglicemia). Existe uma forma hereditária, ou congênita, que provoca hipoglicemias em bebês. Algumas vezes, essa doença pode ser tratada com medicações, mas freqüentemente é necessária a remoção cirúrgica de parte ou todo o pâncreas. Um tumor do pâncreas que secreta insulina (insulinoma) é uma causa menos comum de hipoglicemia. Os sintomas da hipoglicemia incluem: ansiedade, suor em excesso, fraqueza, fome, confusão, sensação de “cabeça vazia” e taquicardia. O baixo nível de glicose no sangue estimula a liberação de hormônios como o glucagon, a adrenalina e o hormônio de crescimento, que ajudam a glicose a retornar aos níveis normais.
Hipófise
A hipófise (antigamente conhecida como pituitária) é algumas vezes chamada de “glândula-mestra”, devido à sua grande influência em outros órgãos do corpo. Sua função é complexa e fundamental para o bem-estar geral do indivíduo.
A hipófise é dividida em 2 partes: a anterior (ou adeno-hipófise) e a posterior (ou neuro-hipófise).
A hipófise anterior produz vários hormônios:
a) Prolactina (PRL) – Estimula a produção de leite nas mulheres, após o parto, e pode afetar os níveis de hormônios provenientes dos ovários (em mulheres) e dos testículos (em homens).
b) Hormônio de Crescimento (GH, do nome em inglês: Growth Hormone) – Estimula o crescimento nas crianças e é importante para manter uma composição corporal saudável na vida adulta, pois atua na manutenção da massa muscular, da densidade mineral óssea e da distribuição de gordura pelo corpo.
c) Hormônio Adrenocorticotrófico (ACTH) – Estimula a produção de um importante hormônio pelas glândulas supra-renais, o cortisol. Este é considerado um “hormônio do stress”, e ajuda a manter os níveis normais de glicemia e pressão arterial, e por isso é indispensável à sobrevivência.
d) Hormônio Estimulador da Tireóide (TSH) – Estimula a tireóide a produzir e secretar hormônios tireoidianos, os quais regulam o metabolismo corpóreo, a produção de energia, o crescimento e desenvolvimento e a atividade do sistema nervoso central.
e) Hormônio Luteinizante (LH) – Regula a produção dos hormônios sexuais: testosterona nos homens e estrógenos nas mulheres.
f) Hormônio Folículo-Estimulante (FSH) – Promove a produção de esperma nos homens e estimula os ovários a liberar óvulos nas mulheres. O LH e o FSH agem em conjunto para permitir a função normal das glândulas sexuais: ovários e testículos.
Já a hipófise posterior armazena e secreta 2 hormônios diferentes:
a) Ocitocina – Provoca a ejeção (“descida”) do leite em mulheres que estão amamentando e a contração uterina durante o trabalho de parto.
b) Hormônio Anti-Diurético (ADH, ou Vasopressina) – Regula o balanço da quantidade de água no corpo. Quando este hormônio não é secretado corretamente, isso pode levar à perda exagerada de água através da urina, o chamado diabetes insipidus. Isso pode levar a problemas renais sérios, e até à falência dos rins (insuficiência renal) se não for instituído o tratamento adequado.
OBS.: Não confunda diabetes mellitus com diabetes insipidus. Diabetes mellitus é a elevação dos níveis de açúcar (glicose) no sangue, devido a falhas na produção ou na ação da insulina. Diabetes insipidus é a perda excessiva de água pelos rins, devido a problemas com a produção ou com a ação do hormônio anti-diurético (ADH).
Como a glândula hipófise produz hormônios que regulam o funcionamento de praticamente todas as demais glândulas endócrinas do organismo, é fácil deduzir que doenças da hipófise podem se manifestar com o excesso ou a deficiência de hormônios os mais diversos, tanto da hipófise como das glândulas-alvo. Por exemplo: a produção aumentada de hormônio de crescimento pode levar ao gigantismo (crescimento exagerado), e a deficiência desse mesmo hormônio pode causar nanismo (baixa estatura).
Supra-Renais
As glândulas supra-renais, ou adrenais, ficam localizadas acima dos rins. Cada supra-renal é, na verdade, 2 glândulas, visto que é formada por uma porção interna (medula adrenal) e uma porção externa (córtex adrenal). Os hormônios do córtex adrenal são essenciais à manutenção da vida; os hormônios da medula adrenal, não.
O córtex adrenal produz os seguintes hormônios:
a) Cortisol (glicocorticóide) – ajudam no controle dos níveis de glicose no sangue, aumentam a queima de gorduras e proteínas para produção de energia e aumentam na vigência de stress (como, por exemplo, na presença de febre, doenças graves e acidentes com trauma).
b) Aldosterona (mineralocorticóide) – controla o volume de sangue e ajuda a regular a pressão arterial, agindo nos rins para estimulá-los a reter sódio e água.
c) Andrógenos adrenais – importantes para algumas características sexuais secundárias, tanto em mulheres como em homens.
Exemplos de doenças causadas por problemas do córtex adrenal são: a Síndrome de Cushing, causada pelo excesso de cortisol, e a Síndrome de Addison, provocada pela deficiência do cortisol.
A medula adrenal produz adrenalina (ou epinefrina) e noradrenalina (ou norepinefrina), hormônios também secretados pelas terminações nervosas e que aumentam a freqüëncia dos batimentos cardíacos, abrem as vias aéreas para melhorar a entrada de oxigênio, e aumentam o fluxo sangüíneo para os músculos, geralmente quando uma pessoa encontra-se em situação ameaçadora, assustada, excitada ou sob stress intenso. Portanto, esses hormônios melhoram a capacidade da pessoa proteger-se, através da fuga ou da luta (to fight or to flight).
As glândulas supra-renais, ou adrenais, ficam localizadas acima dos rins. Cada supra-renal é, na verdade, 2 glândulas, visto que é formada por uma porção interna (medula adrenal) e uma porção externa (córtex adrenal). Os hormônios do córtex adrenal são essenciais à manutenção da vida; os hormônios da medula adrenal, não.
O córtex adrenal produz os seguintes hormônios:
a) Cortisol (glicocorticóide) – ajudam no controle dos níveis de glicose no sangue, aumentam a queima de gorduras e proteínas para produção de energia e aumentam na vigência de stress (como, por exemplo, na presença de febre, doenças graves e acidentes com trauma).
b) Aldosterona (mineralocorticóide) – controla o volume de sangue e ajuda a regular a pressão arterial, agindo nos rins para estimulá-los a reter sódio e água.
c) Andrógenos adrenais – importantes para algumas características sexuais secundárias, tanto em mulheres como em homens.
Exemplos de doenças causadas por problemas do córtex adrenal são: a Síndrome de Cushing, causada pelo excesso de cortisol, e a Síndrome de Addison, provocada pela deficiência do cortisol.
A medula adrenal produz adrenalina (ou epinefrina) e noradrenalina (ou norepinefrina), hormônios também secretados pelas terminações nervosas e que aumentam a freqüëncia dos batimentos cardíacos, abrem as vias aéreas para melhorar a entrada de oxigênio, e aumentam o fluxo sangüíneo para os músculos, geralmente quando uma pessoa encontra-se em situação ameaçadora, assustada, excitada ou sob stress intenso. Portanto, esses hormônios melhoram a capacidade da pessoa proteger-se, através da fuga ou da luta (to fight or to flight).
Paratireóides
Localizadas atrás da glândula tireóide, no pescoço, as paratireóides são 4 pequenas glândulas que produzem hormônios importantes para a regulação dos íons cálcio e fósforo no sangue. As paratireóides são indispensáveis para o desenvolvimento ósseo adequado, visto que o cálcio e o fósforo são os principais minerais componentes da matriz óssea. Em resposta à pouca quantidade de cálcio na dieta, por exemplo, as paratireóides secretam o paratormônio (PTH), que retira cálcio dos ossos para que o nível sangüíneo de cálcio continue normal. Os níveis de cálcio no sangue precisam ser mantidos estáveis porque são importantes para a condução nervosa e a contração muscular.
Se as paratireóides forem removidas, como pode acontecer em algumas situações (por exemplo, cirurgia para retirada da tireóide), o cálcio do sangue cai para valores muito baixos (hipocalcemia), o que produz diversos sintomas, tais como: arritmias cardíacas, espasmos e cãibras musculares, formigamento (parestesias) nas mãos e pés e dificuldade para respirar. Esse quadro, provocado pela deficiência de paratormônio, é chamado hipoparatireoidismo.
Existem doenças que podem provocar o excesso de PTH, ou hiperparatireoidismo, como alguns tumores das paratireóides ou alguns distúrbios renais graves. Nesse caso, observam-se: dores ósseas, pedras nos rins, aumento do volume de urina, fraqueza muscular e fadiga crônica, podendo em alguns casos ocorrer fraturas severas devido ao enfraquecimento dos ossos pela retirada de cálcio.
Localizadas atrás da glândula tireóide, no pescoço, as paratireóides são 4 pequenas glândulas que produzem hormônios importantes para a regulação dos íons cálcio e fósforo no sangue. As paratireóides são indispensáveis para o desenvolvimento ósseo adequado, visto que o cálcio e o fósforo são os principais minerais componentes da matriz óssea. Em resposta à pouca quantidade de cálcio na dieta, por exemplo, as paratireóides secretam o paratormônio (PTH), que retira cálcio dos ossos para que o nível sangüíneo de cálcio continue normal. Os níveis de cálcio no sangue precisam ser mantidos estáveis porque são importantes para a condução nervosa e a contração muscular.
Se as paratireóides forem removidas, como pode acontecer em algumas situações (por exemplo, cirurgia para retirada da tireóide), o cálcio do sangue cai para valores muito baixos (hipocalcemia), o que produz diversos sintomas, tais como: arritmias cardíacas, espasmos e cãibras musculares, formigamento (parestesias) nas mãos e pés e dificuldade para respirar. Esse quadro, provocado pela deficiência de paratormônio, é chamado hipoparatireoidismo.
Existem doenças que podem provocar o excesso de PTH, ou hiperparatireoidismo, como alguns tumores das paratireóides ou alguns distúrbios renais graves. Nesse caso, observam-se: dores ósseas, pedras nos rins, aumento do volume de urina, fraqueza muscular e fadiga crônica, podendo em alguns casos ocorrer fraturas severas devido ao enfraquecimento dos ossos pela retirada de cálcio.
Hipotálamo
O hipotálamo é uma parte do cérebro que fica exatamente acima da glândula hipófise. O hipotálamo produz hormônios que agem diretamente na hipófise, estimulando ou inibindo a liberação dos hormônios hipofisários. Alguns dos hormônios hipofisários são: o GHRH (que estimula a liberação do GH), o TRH (que estimula a liberação do TSH), o CRH (que estimula a liberação do ACTH) e o GnRH (que estimula a liberação de LH e FSH). O hipotálamo também produz o neurotransmissor dopamina, que inibe a liberação de prolactina pela hipófise. Portanto, o hipotálamo, por controlar diretamente a função da glândula-mestra, a hipófise, constitui o elo de ligação entre o sistema nervoso central (cérebro) e o sistema endócrino.
O hipotálamo é uma parte do cérebro que fica exatamente acima da glândula hipófise. O hipotálamo produz hormônios que agem diretamente na hipófise, estimulando ou inibindo a liberação dos hormônios hipofisários. Alguns dos hormônios hipofisários são: o GHRH (que estimula a liberação do GH), o TRH (que estimula a liberação do TSH), o CRH (que estimula a liberação do ACTH) e o GnRH (que estimula a liberação de LH e FSH). O hipotálamo também produz o neurotransmissor dopamina, que inibe a liberação de prolactina pela hipófise. Portanto, o hipotálamo, por controlar diretamente a função da glândula-mestra, a hipófise, constitui o elo de ligação entre o sistema nervoso central (cérebro) e o sistema endócrino.
Ovários
Os ovários são glândulas localizadas no abdome inferior das mulheres, responsáveis pela produção dos 2 mais importantes hormônios sexuais femininos: o estrógeno e a progesterona. Esses hormônios são responsáveis pelo desenvolvimento e a manutenção dos caracteres sexuais secundários femininos (ou seja, o crescimento das mamas, o aparecimento dos ciclos menstruais, a pilificação de padrão feminino e a distribuição de gordura corporal típica). Também são fundamentais para a reprodução, pois controlam o ciclo menstrual (junto com o LH e o FSH), liberam óvulos ciclicamente (ovulação) e ajudam a criar as condições necessárias para a gestação. Os ovários produzem, ainda, a inibina (que inibe a liberação de FSH pela hipófise e ajuda no desenvolvimento dos óvulos) e uma pequena quantidade de hormônios masculinos.
A alteração mais comum do funcionamento dos ovários é a menopausa, que é parte do processo normal de envelhecimento e consiste na parada da ovulação e na redução acentuada da produção de estrógeno e progesterona, o que normalmente ocorre por volta dos 50 anos de idade. Um quadro semelhante pode ocorrer quando os ovários são removidos cirurgicamente. Algumas conseqüências da menopausa são: ondas de calor, alterações do humor (ansiedade, tristeza, instabilidade emocional), perda de massa óssea (osteoporose) e atrofia da mucosa vaginal.
Outra alteração extremamente comum dos ovários é a chamada Síndrome dos Ovários Micropolicísticos (SOMP), que é causada pela produção excessiva de hormônios masculinos pelos ovários, muitas vezes relacionada ao excesso de peso e a problemas na ação da insulina (resistência insulínica). A SOMP pode cursar com irregularidade ou ausência dos ciclos menstruais, dificuldade para engravidar (infertilidade) e manifestações do excesso de hormônios masculinos, como: acne severa, aumento de pêlos, oleosidade excessiva da pele e cabelos e queda de cabelos. A longo prazo, as mulheres com SOMP apresentam um risco aumentado de desenvolver complicações como: diabetes mellitus tipo 2, aumento do colesterol, hipertensão arterial e doenças cardiovasculares. ( Leia mais sobre a síndrome dos ovários micropolicísticos clicando aqui )
Os ovários são glândulas localizadas no abdome inferior das mulheres, responsáveis pela produção dos 2 mais importantes hormônios sexuais femininos: o estrógeno e a progesterona. Esses hormônios são responsáveis pelo desenvolvimento e a manutenção dos caracteres sexuais secundários femininos (ou seja, o crescimento das mamas, o aparecimento dos ciclos menstruais, a pilificação de padrão feminino e a distribuição de gordura corporal típica). Também são fundamentais para a reprodução, pois controlam o ciclo menstrual (junto com o LH e o FSH), liberam óvulos ciclicamente (ovulação) e ajudam a criar as condições necessárias para a gestação. Os ovários produzem, ainda, a inibina (que inibe a liberação de FSH pela hipófise e ajuda no desenvolvimento dos óvulos) e uma pequena quantidade de hormônios masculinos.
A alteração mais comum do funcionamento dos ovários é a menopausa, que é parte do processo normal de envelhecimento e consiste na parada da ovulação e na redução acentuada da produção de estrógeno e progesterona, o que normalmente ocorre por volta dos 50 anos de idade. Um quadro semelhante pode ocorrer quando os ovários são removidos cirurgicamente. Algumas conseqüências da menopausa são: ondas de calor, alterações do humor (ansiedade, tristeza, instabilidade emocional), perda de massa óssea (osteoporose) e atrofia da mucosa vaginal.
Outra alteração extremamente comum dos ovários é a chamada Síndrome dos Ovários Micropolicísticos (SOMP), que é causada pela produção excessiva de hormônios masculinos pelos ovários, muitas vezes relacionada ao excesso de peso e a problemas na ação da insulina (resistência insulínica). A SOMP pode cursar com irregularidade ou ausência dos ciclos menstruais, dificuldade para engravidar (infertilidade) e manifestações do excesso de hormônios masculinos, como: acne severa, aumento de pêlos, oleosidade excessiva da pele e cabelos e queda de cabelos. A longo prazo, as mulheres com SOMP apresentam um risco aumentado de desenvolver complicações como: diabetes mellitus tipo 2, aumento do colesterol, hipertensão arterial e doenças cardiovasculares. ( Leia mais sobre a síndrome dos ovários micropolicísticos clicando aqui )
Testículos
Os homens possuem 2 glândulas reprodutivas gêmeas, chamadas testículos, que produzem o hormônio sexual masculino, a testosterona. A testosterona é responsável pelo aparecimento, na puberdade, das características sexuais secundárias do sexo masculino (aumento de massa muscular, pilificação, barba, engrossamento da voz, crescimento dos órgãos genitais e produção de espermatozóides), e pela sua manutenção na vida adulta. Os testículos também são o local de produção dos espermatozóides, as células reprodutoras masculinas.
O câncer do testículo, que é a forma mais comum de câncer em homens entre os 15 e 35 anos de idade, pode necessitar de tratamento cirúrgico com a remoção de um ou dois testículos. A diminuição ou ausência de testosterona que surge então (chamada hipogonadismo) pode levar à perda de desejo sexual, impotência, alterações da imagem corporal, perda da massa óssea e da força muscular e transtornos do humor.
Os homens possuem 2 glândulas reprodutivas gêmeas, chamadas testículos, que produzem o hormônio sexual masculino, a testosterona. A testosterona é responsável pelo aparecimento, na puberdade, das características sexuais secundárias do sexo masculino (aumento de massa muscular, pilificação, barba, engrossamento da voz, crescimento dos órgãos genitais e produção de espermatozóides), e pela sua manutenção na vida adulta. Os testículos também são o local de produção dos espermatozóides, as células reprodutoras masculinas.
O câncer do testículo, que é a forma mais comum de câncer em homens entre os 15 e 35 anos de idade, pode necessitar de tratamento cirúrgico com a remoção de um ou dois testículos. A diminuição ou ausência de testosterona que surge então (chamada hipogonadismo) pode levar à perda de desejo sexual, impotência, alterações da imagem corporal, perda da massa óssea e da força muscular e transtornos do humor.
Timo
O timo é uma glândula necessária no início da vida para o desenvolvimento adequado do sistema de defesa do organismo (sistema imune, ou linfóide). Ele é grande no bebê recém-nascido, e atinge seu tamanho máximo durante a puberdade, mas daí em diante o timo vai sendo progressivamente substituído por gordura, até praticamente desaparecer na vida adulta. O timo secreta fatores humorais, hormônios importantes para a maturação da resposta imunológica.
O timo é uma glândula necessária no início da vida para o desenvolvimento adequado do sistema de defesa do organismo (sistema imune, ou linfóide). Ele é grande no bebê recém-nascido, e atinge seu tamanho máximo durante a puberdade, mas daí em diante o timo vai sendo progressivamente substituído por gordura, até praticamente desaparecer na vida adulta. O timo secreta fatores humorais, hormônios importantes para a maturação da resposta imunológica.
Glândula Pineal
A glândula pineal ainda é alvo de intensos estudos por parte dos cientistas, pois seu funcionamento e sua importância ainda não foram completamente esclarecidos. A pineal fica localizada no interior do cérebro e produz a melatonina, um hormônio que pode influenciar a função dos ovários e testículos e também pode ajudar a controlar os padrões de sono e vigília de um indivíduo.
A glândula pineal ainda é alvo de intensos estudos por parte dos cientistas, pois seu funcionamento e sua importância ainda não foram completamente esclarecidos. A pineal fica localizada no interior do cérebro e produz a melatonina, um hormônio que pode influenciar a função dos ovários e testículos e também pode ajudar a controlar os padrões de sono e vigília de um indivíduo.
Placenta
A placenta, além de fazer a conexão entre a mãe e o feto durante a gravidez, produz vários hormônios que ajudam na manutenção da gestação e no preparo das mamas para a amamentação. Alguns desses hormônios são: a gonadotrofina coriônica humana (hCG), o lactogênio placentário (hPL) e o estrógeno e a progesterona.
A placenta, além de fazer a conexão entre a mãe e o feto durante a gravidez, produz vários hormônios que ajudam na manutenção da gestação e no preparo das mamas para a amamentação. Alguns desses hormônios são: a gonadotrofina coriônica humana (hCG), o lactogênio placentário (hPL) e o estrógeno e a progesterona.
Pele, Fígado e Rins
Esses três órgãos agem em conjunto para produzir a 1,25-di-hidroxi-vitamina D, que é a forma biologicamente ativa da vitamina D. Essa vitamina, juntamente com o paratormônio, age na manutenção dos níveis de cálcio e fósforo no sangue.
Esses três órgãos agem em conjunto para produzir a 1,25-di-hidroxi-vitamina D, que é a forma biologicamente ativa da vitamina D. Essa vitamina, juntamente com o paratormônio, age na manutenção dos níveis de cálcio e fósforo no sangue.
Estômago e Intestino Delgado
O trato digestivo é o maior sistema orgânico relacionado à função endócrina, pois secreta vários hormônios importantes que regulam o metabolismo corporal, tais como a ghrelina e o peptídeo YY3-36, que regulam o apetite e podem ter um papel fundamental na regulação do peso corporal e na gênese da obesidade.
O trato digestivo é o maior sistema orgânico relacionado à função endócrina, pois secreta vários hormônios importantes que regulam o metabolismo corporal, tais como a ghrelina e o peptídeo YY3-36, que regulam o apetite e podem ter um papel fundamental na regulação do peso corporal e na gênese da obesidade.
Tecido Adiposo
O tecido adiposo produz várias substâncias importantes para a regulação dos estoques de energia no corpo, dos quais um dos mais estudados é a leptina, que pode ter ação ainda na regulação da ação da insulina em diversos tecidos.
O tecido adiposo produz várias substâncias importantes para a regulação dos estoques de energia no corpo, dos quais um dos mais estudados é a leptina, que pode ter ação ainda na regulação da ação da insulina em diversos tecidos.
Coração
O coração produz um hormônio chamado peptídeo natriurético atrial, que produz aumento da perda renal de sódio e dilatação dos vasos sangüíneos em resposta a situações de aumento do volume de sangue circulante e aumento da pressão arterial.
O coração produz um hormônio chamado peptídeo natriurético atrial, que produz aumento da perda renal de sódio e dilatação dos vasos sangüíneos em resposta a situações de aumento do volume de sangue circulante e aumento da pressão arterial.
FONTE: http://www.portalendocrino.com.br/sistema_endocrino.shtml
Marcadores:
ANATOMIA
Assinar:
Postagens (Atom)
 https://orcid.org/0000-0002-6084-7313
https://orcid.org/0000-0002-6084-7313